2.9 Výpočet molární koncentrace roztoku ze zadané hmotnosti rozpuštěné látky a objemu roztoku
Vypočtěte molární koncentraci roztoku hydroxidu sodného o objemu 2 dm3, který vznikl rozpuštěním 80 g NaOH ve vodě.
Řešení:
 = 2 dm3
= 2 dm3
m(NaOH) = 80 g
c(NaOH) = ?
1. postup – úvahou s využitím přímé úměrnosti
víme, že molární koncentrace podle (95) udává počet molů čisté látky (NaOH) rozpuštěné v 1 dm3 roztoku
nejdříve najdeme látkové množství NaOH v 2 dm3 roztoku:
víme, že hmotnost 1 molu NaOH udává jeho molární hmotnost M(NaOH) ≐ 40,00 g⋅mol-1
 můžeme tedy využít úměru (36): 1 mol NaOH..........40,00 g
můžeme tedy využít úměru (36): 1 mol NaOH..........40,00 ghledané látkové množství 80 g NaOH můžeme vypočítat užitím přímé úměrnosti:

1 mol .................. 40 g 
x mol .................. 80 g x : 1 = 80 : 40 x = 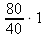
x = 2 moly NaOH ~ n(NaOH) v 2 dm3 roztoku
hledanou molární koncentraci NaOH v 2 dm3 roztoku můžeme podle a. vypočítat užitím přímé úměrnosti:

2 moly .................. 2 dm3 
x mol .................. 1 dm3 x : 2 = 1 : 2 x = 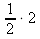
x = 1 mol NaOH  c(NaOH) = 1 mol⋅dm-3
c(NaOH) = 1 mol⋅dm-3
2. postup – postupným dosazováním do jednoduchých vztahů
molární koncentrace je definovaná jako
 (92) – hodnota
(92) – hodnota  je zadaná, budeme proto hledat látkové množství rozpuštěného NaOH v roztoku
je zadaná, budeme proto hledat látkové množství rozpuštěného NaOH v roztokuvýpočet látkového množství NaOH:
využijeme odvozenývztah (28) pro látkové množství:

do vztahu z A. dosadíme zadanou hodnotu m(NaOH) = 80 g a z tabulek M(NaOH) ≐ 40,00 g⋅mol-1:
n(NaOH) =
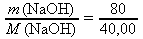 = 2 mol
= 2 mol
do vztahu z a. dosadíme n(NaOH) ≐ 2 mol z b. a zadanou hodnotu
 = 2 dm3:
= 2 dm3:c(NaOH) =
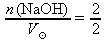 = 1 mol⋅dm-3
= 1 mol⋅dm-3
3. postup – dosazením do odvozeného vztahu
molární koncentrace je definovaná jako
 (92) – hodnota
(92) – hodnota  je zadaná, budeme proto potřebovat jen vztah pro látkové množství rozpuštěného NaOH v roztoku
je zadaná, budeme proto potřebovat jen vztah pro látkové množství rozpuštěného NaOH v roztokuvyužijeme odvozený vztah (28) pro látkové množství:

do vztahu z a. dosadíme vztah z b.:
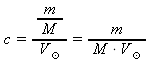
do odvozeného vztahu z c. dosadíme zadané hodnoty m(NaOH) = 80 g a
 = 2 dm3 a z tabulek M(NaOH) ≐ 40,00 g⋅mol-1:
= 2 dm3 a z tabulek M(NaOH) ≐ 40,00 g⋅mol-1:c(NaOH) =
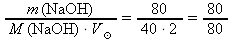 = 1 mol⋅dm-3
= 1 mol⋅dm-3
Odpověď: Molární koncentrace roztoku NaOH je 1 mol⋅dm-3 neboli roztok NaOH je 1M.
2.10 Výpočet hmotnosti látky potřebné na přípravu roztoku dané molární koncentrace a objemu
Kolik gramů dusitanu sodného je třeba na přípravu 400 cm3 4M roztoku této látky?
Řešení:
 = 400 cm3
= 400 cm3
c(NaNO2) = 4 mol⋅dm-3
m(NaNO2) = ? g
1. postup – úvahou s využitím přímé úměrnosti
víme, že molární koncentrace podle (95) udává počet molů čisté látky (NaNO2) rozpuštěné v 1 dm3 roztoku
 užitím přímé úměrnosti můžeme vypočítat látkové množství NaNO2 potřebné na přípravu 400 cm3 = 0,4 dm3 roztoku:
užitím přímé úměrnosti můžeme vypočítat látkové množství NaNO2 potřebné na přípravu 400 cm3 = 0,4 dm3 roztoku:
4 moly .................. 1 dm3 
x mol .................. 0,4 dm3 x : 4 = 0,4 : 1 x = 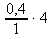 = 0,4 ⋅ 4
= 0,4 ⋅ 4x = 1,6 mol NaNO2 ~ n(NaNO2) z látkového množství NaNO2 z a. vypočteme jeho hmotnost:
víme, že hmotnost 1 molu NaNO2 udává jeho molární hmotnost M(NaNO2) ≐ 69,00 g⋅mol-1
 můžeme tedy využít úměru (36): 69,00 g...........1 mol NaNO2
můžeme tedy využít úměru (36): 69,00 g...........1 mol NaNO2hledanou hmotnost 1,6 molu NaNO2 můžeme vypočítat užitím přímé úměrnosti:

69,00 g .................. 1 mol 
x g .................. 1,6 mol x : 69,00 = 1,6 : 1 x = 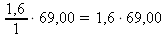
x = 110,40 g NaNO2 ~ m(NaNO2)
2. postup – úvahou s využitím přímé úměrnosti
zjistíme, jaké množství NaNO2 v g bychom museli rozpustit, aby vznikl 4M roztok
víme, že hmotnost 1 molu NaNO2 udává jeho molární hmotnost M(NaNO2) ≐ 69,00 g⋅mol-1
 můžeme tedy využít úměru (36): 69,00 g...........1 mol NaNO2
můžeme tedy využít úměru (36): 69,00 g...........1 mol NaNO2hledanou hmotnost 4 molů NaNO2 můžeme vypočítat užitím přímé úměrnosti:

69,00 g .................. 1 mol 
x g .................. 4 moly x : 69,00 = 4 : 1 x = 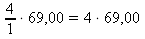
x = 276 g NaNO2 ~ m(NaNO2) na přípravu 1 dm3 roztoku
z a. víme, že na přípravu 1 dm3 roztoku je potřeba 276 g NaNO2
 užitím přímé úměrnosti vypočteme kolik g NaNO2 je potřeba na přípravu 400 cm3 = 0,4 dm3 roztoku:
užitím přímé úměrnosti vypočteme kolik g NaNO2 je potřeba na přípravu 400 cm3 = 0,4 dm3 roztoku:
276 g .................. 1 dm3 
x g .................. 0,4 dm3 x : 276 = 0,4 : 1 x = 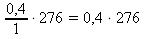
x = 110,4 g NaNO2 ~ m(NaNO2) na přípravu 0,4 dm3 roztoku
3. postup – postupným dosazováním do jednoduchých vztahů
nejdříve vypočteme látkové množství NaNO2 potřebné na přípravu roztoku:
využijeme odvozený vztah (93) pro látkové množství:
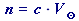
do vztahu z A. dosadíme zadané hodnoty c(NaNO2) = 4 mol⋅dm-3 a
 = 400 cm3 = 0,4 dm3:
= 400 cm3 = 0,4 dm3:n(NaNO2) = c(NaNO2) ⋅
 = 4 ⋅ 0,4 = 1,6 mol NaNO2
= 4 ⋅ 0,4 = 1,6 mol NaNO2
nyní již můžeme určit hmotnost NaNO2 potřebnou na přípravu roztoku:
využijeme odvozený vztah (27) pro hmotnost:

do vztahu z A. dosadíme n(NaNO2) = 1,6 mol z a. a z tabulek M(NaNO2) ≐ 69,00 g⋅mol-1:
m(NaNO2) = n(NaNO2) ⋅M(NaNO2) = 1,6 ⋅ 69,00 = 110,4 g NaNO2
4. postup – dosazením do odvozeného vztahu
využijeme odvozený vztah (93) pro látkové množství:
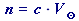
dále využijeme odvozený vztah (27) pro hmotnost:

vztah z a. dosadíme do vztahu z b.:
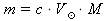
do odvozeného vztahu z c. dosadíme zadané hodnoty c(NaNO2) = 4 mol⋅dm-3 a
 = 400 cm3 = 0,4 dm3 a z tabulek M(NaNO2) ≐ 69,00 g⋅mol-1:
= 400 cm3 = 0,4 dm3 a z tabulek M(NaNO2) ≐ 69,00 g⋅mol-1:m(NaNO2) =
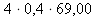 = 110,40 g
= 110,40 g
Odpověď: Na přípravu roztoku je třeba 110,40 gramů dusitanu sodného.
2.11 Výpočet objemu látky a rozpouštědla potřebných na přípravu roztoku dané molární koncentrace a objemu
Kolik cm3 20% kyseliny sírové (ρ20% = 1,1394 g⋅cm-3) a kolik cm3 vody je potřeba na přípravu 1,5 dm3 2,064M roztoku této látky o hustotě 1,1243 g⋅cm-3?
Řešení:
w%(H2SO4) = 20 %
ρ20% = 1,1394 g⋅cm-3
 = 1,5 dm3
= 1,5 dm3
c(H2SO4) = 2,064 mol⋅dm-3
 = 1,1243 g⋅cm-3
= 1,1243 g⋅cm-3
V(H2SO4) = ? cm3
V(H2O) = ? cm3
nejdříve vypočteme hmotnost čisté (100%) kyseliny sírové potřebné na přípravu roztoku:
využijeme odvozený vztah (93) pro látkové množství:
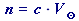
dále využijeme odvozený vztah (27) pro hmotnost:

vztah z A. dosadíme do vztahu z B.:
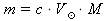
do odvozeného vztahu z C. dosadíme zadané hodnoty c(H2SO4) = 2,064 mol⋅dm-3 a
 = 1,5 dm3 a z tabulek M(H2SO4) ≐ 98,08 g⋅mol-1:
= 1,5 dm3 a z tabulek M(H2SO4) ≐ 98,08 g⋅mol-1:m(H2SO4) = 2,064 ⋅ 1,5 ⋅ 98,08 ≐ 303,66 g 100% kyseliny
roztok však máme připravit ne ze 100%, ale z 20% kyseliny
 provedeme přepočet
provedeme přepočetstačí si uvědomit, že hmotnost roztoku kyseliny je nepřímo úměrná jeho procentuální koncentraci (podle (64) a (61) platí: čím více je v roztoku rozpouštědla a tedy i čím větší je hmotnost roztoku, tím je jeho hmotnostní zlomek a koncentrace menší)
hmotnost 20% kyseliny tedy můžeme vypočítat užitím nepřímé úměrnosti:

303,66 g .................. 100 % 
x g .................. 20 % x : 303,66 = 100 : 20 x = 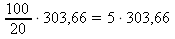
x ≐ 1518,3 g ~ m20% H2SO4
hmotnost 20% kyseliny z b. převedeme na objem
využijeme odvozený vztah (47) pro objem:
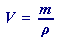
do vztahu z A. dosadíme m20% = 1518,3 g a zadanou hodnotu ρ20% = 1,1394 g⋅cm-3:
V(H2SO4) =
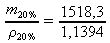 = 1332,54 cm3
= 1332,54 cm3
nyní vypočteme hmotnost vody potřebnou k přípravě roztoku
podle (67) platí, že součet hmotností všech látek obsažených v roztoku je roven celkové hmotnosti roztoku, tj.
 = m20%(H2SO4) + m(H2O)
= m20%(H2SO4) + m(H2O)hmotnost vody lze tedy podle A. vypočítat jako rozdíl hmotnosti roztoku a hmotnosti 20% kyseliny: m(H2O) =
 − m20%(H2SO4)
− m20%(H2SO4)vypočteme celkovou hmotnost připravovaného roztoku

využijeme odvozený vztah (48) pro hmotnost:

do vztahu z i. dosadíme zadané hodnoty
 = 1,2349 g⋅cm-3 a
= 1,2349 g⋅cm-3 a = 1,5 dm3 = 1500 cm3:
= 1,5 dm3 = 1500 cm3: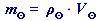 = 1,1243 ⋅ 1500 ≐ 1686,45 g
= 1,1243 ⋅ 1500 ≐ 1686,45 g
hmotnost vody vypočteme ze vztahu B. dosazením
 = 1686,45 g z dCii. a m20% = 1518,3 g z b.:
= 1686,45 g z dCii. a m20% = 1518,3 g z b.:m(H2O) =
 − m20%(H2SO4) = 1686,45 − 1518,3 = 168,15 g ~ 168,15 cm3 (podle (54))
− m20%(H2SO4) = 1686,45 − 1518,3 = 168,15 g ~ 168,15 cm3 (podle (54))
Odpověď: Na přípravu roztoku je třeba 1332,54 cm3 gramů 20% kyseliny sírové a 168,15 cm3 vody.
2.12 Přepočet molární koncentrace na hmotnostní procenta
Jaká je procentová koncentrace 2,03M roztoku kyseliny dusičné o hustotě 1,0661 g⋅cm-3?
Řešení:
c(HNO3) = 2,03 mol⋅dm-3
 = 1,0661 g⋅cm-3
= 1,0661 g⋅cm-3
w%(HNO3) = ?
1. postup – úvahou s využitím přímé úměrnosti
abychom mohli potřebné údaje ze známé koncentrace c vypočítat, je třeba zvolit jednu nezávislou veličinu – např. objem roztoku
 = 1 dm3 (příp. látkové množství n = 1 mol)
= 1 dm3 (příp. látkové množství n = 1 mol)vypočteme hmotnost čisté HNO3 v 1 dm3 roztoku
víme, že molární koncentrace podle (95) udává počet molů čisté látky (HNO3) rozpuštěné v 1 dm3 roztoku
 1 dm3...........2,03 mol
1 dm3...........2,03 molvíme, že hmotnost 1 molu HNO3 udává její molární hmotnost M(HNO3) ≐ 63,01 g⋅mol-1
 můžeme tedy využít úměru (36): 63,01 g...........1 mol
můžeme tedy využít úměru (36): 63,01 g...........1 molúdaje z A. a B. sestavíme do trojčlenky:

63,01 g .................. 1 mol 
x g .................. 2,03 mol x : 63,01 = 2,03 : 1 x = 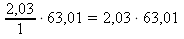
x = 127,91 g HNO3 ~ m(HNO3)
vypočteme hmotnost 1 dm3 roztoku

využijeme odvozený vztah (48) pro hmotnost:

do vztahu z A. dosadíme zadané hodnoty
 = 1,0661 g⋅cm-3 a
= 1,0661 g⋅cm-3 a = 1 dm3 = 1000 cm3:
= 1 dm3 = 1000 cm3: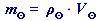 = 1,0661 ⋅ 1000 ≐ 1066,1 g
= 1,0661 ⋅ 1000 ≐ 1066,1 g
vypočteme procentovou koncentraci roztoku
stačí si uvědomit, že hmotnost roztoku je nepřímo úměrná jeho procentuální koncentraci (podle (64) a (61) platí: čím více je v roztoku rozpouštědla a tedy i čím větší je hmotnost roztoku, tím je jeho hmotnostní zlomek a koncentrace menší)
hmotnost HNO3 (127,91 g) odpovídá 100% roztoku, a proto hmotnostní procento 1066,1 g roztoku můžeme vypočítat užitím nepřímé úměrnosti:

100 % .................. 127,91 g 
x % .................. 1066,1 g x : 100 = 127,91 : 1066,1 x = 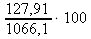
x ≐ 12,00 % ~ w%(HNO3)
2. postup – postupným dosazováním do jednoduchých vztahů
nejdříve si uvědomíme definici procentové koncentrace neboli hmotnostního procenta
využijeme definičních vztahů hmotnostního zlomku látky X v roztoku
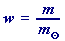 (64) a hmotnostního procenta
(64) a hmotnostního procenta  (61)
(61)vztah (64) z A. dosadíme do vzahu (61):
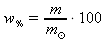
 chceme tedy určit hmotnost čisté kyseliny dusičné m(HNO3) a hmotnost jejího 2,03M roztoku
chceme tedy určit hmotnost čisté kyseliny dusičné m(HNO3) a hmotnost jejího 2,03M roztoku 
abychom mohli potřebné údaje ze známé koncentrace c vypočítat, je třeba zvolit jednu nezávislou veličinu – např. objem roztoku
 = 1 dm3 (příp. látkové množství n = 1 mol)
= 1 dm3 (příp. látkové množství n = 1 mol)vypočítáme hmotnost čisté kyseliny dusičné m(HNO3)
využijeme odvozený vztah (93) pro látkové množství:
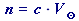
dále využijeme odvozený vztah (27) pro hmotnost:

vztah z A. dosadíme do vztahu z B.:
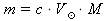
do odvozeného vztahu z C. dosadíme zadanou hodnotu c(HNO3) = 2,03 mol⋅dm-3, zvolenou hodnotu
 = 1 dm3 z b. a z tabulek M(HNO3) ≐ 63,01 g⋅mol-1:
= 1 dm3 z b. a z tabulek M(HNO3) ≐ 63,01 g⋅mol-1:m(HNO3) = 2,03 ⋅ 1 ⋅ 63,01 ≐ 127,91 g čisté kyseliny
vypočteme hmotnost roztoku

využijeme odvozený vztah (48) pro hmotnost:

do vztahu z A. dosadíme zadané hodnoty
 = 1,0661 g⋅cm-3 a
= 1,0661 g⋅cm-3 a = 1 dm3 = 1000 cm3:
= 1 dm3 = 1000 cm3: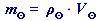 = 1,0661 ⋅ 1000 ≐ 1066,1 g
= 1,0661 ⋅ 1000 ≐ 1066,1 g
vypočítáme hmotnostní procento roztoku dosazením m(HNO3) = 127,91 g z c. a
 = 1066,1 g do vztahu z aB.:
= 1066,1 g do vztahu z aB.: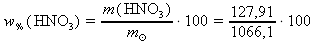 ≐ 12,00 %
≐ 12,00 %
3. postup – dosazením do odvozeného vztahu
odvození vztahu w% =
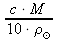 pro přepočet molární koncentrace na procentovou koncentraci neboli hmotnostní procenta je mírně složitější, lze jej však vyhledat v literatuře a použít k výpočtu (my ale odvození níže provedeme)
pro přepočet molární koncentrace na procentovou koncentraci neboli hmotnostní procenta je mírně složitější, lze jej však vyhledat v literatuře a použít k výpočtu (my ale odvození níže provedeme)nejdříve si uvědomíme definici hmotnostního procenta
využijeme definičních vztahů hmotnostního zlomku látky X v roztoku
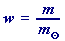 (64) a hmotnostního procenta
(64) a hmotnostního procenta  (61)
(61)vztah (64) z A. dosadíme do vzahu (61):
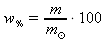
 vyjádříme hmotnost čisté látky m a hmotnost jejího roztoku
vyjádříme hmotnost čisté látky m a hmotnost jejího roztoku 
vyjádření hmotnosti čisté látky m
využijeme odvozený vztah (93) pro látkové množství:
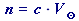
dále využijeme odvozený vztah (27) pro hmotnost:

vztah z A. dosadíme do vztahu z B.:
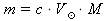
vyjádření hmotnosti roztoku

využijeme odvozený vztah (48) pro hmotnost:

vztah z A. přeznačíme, aby se nepletl s hmotností z c.:
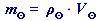
do odvozeného vztahu z b. dosadíme odvozené vztahy z c. a z d. a vyjádříme hmotnostní procento ve správných jednotkách (g⋅cm-3 = kg⋅dm-3):
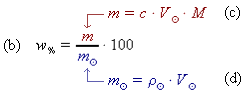

w% = 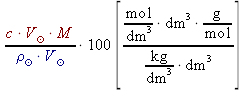 =
= = 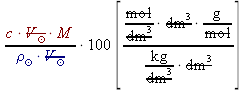 =
= = 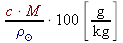 =
= 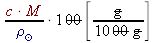 =
= 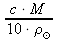
w% =
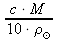 ,
,kde w% ..... procentová koncentrace roztoku (hmotnostní procento).[%] c ..... molární koncentrace [mol⋅dm-3] M ..... molární hmotnost [g⋅mol-1] 
..... hustota roztoku v [g⋅cm-3] do odvozeného vztahu z e. dosadíme zadané hodnoty c(HNO3) = 2,03 mol⋅dm-3,
 = 1,0661 g⋅cm-3 a z tabulek M(HNO3) ≐ 63,01 g⋅mol-1:
= 1,0661 g⋅cm-3 a z tabulek M(HNO3) ≐ 63,01 g⋅mol-1:w% =
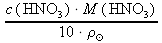 =
= 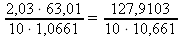 ≐ 12,00 %
≐ 12,00 %
Odpověď: Procentová koncentrace 2,03M roztoku kyseliny dusičné je 12,00 %.
2.13 Přepočet hmotnostních procent na molární koncentraci
Jaká je molární koncentrace 30% kyseliny chlorovodíkové o hustotě 1,1493 g⋅cm-3?
Řešení:
w%(HCl) = 30 %
 = 1,1493 g⋅cm-3
= 1,1493 g⋅cm-3
c(HNO3) = ?
1. postup – postupným dosazováním do jednoduchých vztahů
abychom mohli potřebné údaje ze známé koncentrace c vypočítat, je třeba zvolit jednu nezávislou veličinu – např. objem roztoku
 = 1 dm3 (příp. látkové množství n = 1 mol)
= 1 dm3 (příp. látkové množství n = 1 mol)vypočteme hmotnost 1 dm3 30 % roztoku HCl

využijeme odvozený vztah (48) pro hmotnost:

do vztahu z A. dosadíme zadané hodnoty
 = 1,1493 g⋅cm-3 a
= 1,1493 g⋅cm-3 a = 1 dm3 = 1000 cm3:
= 1 dm3 = 1000 cm3: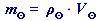 = 1,1493 ⋅ 1000 ≐ 1149,3 g
= 1,1493 ⋅ 1000 ≐ 1149,3 g
vypočteme hmotnost čistého 100% HCl m(HCl) v 30% roztoku
stačí si uvědomit, že hmotnost roztoku je nepřímo úměrná jeho procentuální koncentraci (podle (64) a (61) platí: čím více je v roztoku rozpouštědla a tedy i čím větší je hmotnost roztoku, tím je jeho hmotnostní zlomek a koncentrace menší)
hmotnost 100% HCl tedy můžeme vypočítat užitím nepřímé úměrnosti:

1149,3 g .................. 30 % 
x g .................. 100 % x : 1149,3 = 30 : 100 x = 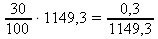
x ≐ 344,79 g ~ m(HCl)
vypočteme molární koncentraci HCl m(HCl)
molární koncentrace je definovaná jako
 (92) – objem roztoku jsme v a. zvolili
(92) – objem roztoku jsme v a. zvolili  = 1 dm3
= 1 dm3  c = n
c = n potřebujeme jen vypočítat látkové množství rozpuštěného HCl v roztoku
potřebujeme jen vypočítat látkové množství rozpuštěného HCl v roztokuvyužijeme odvozený vztah (28) pro látkové množství:

do odvozeného vztahu z B. dosadíme m(NaOH) = 344,79 g z c. a z tabulek M(HCl) ≐ 36,46 g⋅mol-1:
n(HCl) =
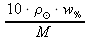 = 9,46 mol
= 9,46 mol  c(HCl) = 9,46 mol⋅dm-3
c(HCl) = 9,46 mol⋅dm-3
2. postup – dosazením do odvozeného vztahu
odvození vztahu w% =
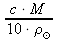 pro přepočet molární koncentrace na procentovou koncentraci neboli hmotnostní procenta je mírně složitější, lze jej však vyhledat v literatuře a použít k výpočtu (my ale odvození níže provedeme)
pro přepočet molární koncentrace na procentovou koncentraci neboli hmotnostní procenta je mírně složitější, lze jej však vyhledat v literatuře a použít k výpočtu (my ale odvození níže provedeme)nejdříve si uvědomíme definici hmotnostního procenta
využijeme definičních vztahů hmotnostního zlomku látky X v roztoku
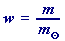 (64) a hmotnostního procenta
(64) a hmotnostního procenta  (61)
(61)vztah (64) z A. dosadíme do vzahu (61):
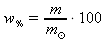
 vyjádříme hmotnost čisté látky m a hmotnost jejího roztoku
vyjádříme hmotnost čisté látky m a hmotnost jejího roztoku 
vyjádření hmotnosti čisté látky m
využijeme odvozený vztah (93) pro látkové množství:
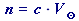
dále využijeme odvozený vztah (27) pro hmotnost:

vztah z A. dosadíme do vztahu z B:
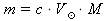
vyjádření hmotnosti roztoku

využijeme odvozený vztah (48) pro hmotnost:

vztah z A. přeznačíme, aby se nepletl s hmotností z c.:
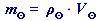
do odvozeného vztahu z b. dosadíme odvozené vztahy z c. a z d. a vyjádříme hmotnostní procento ve správných jednotkách (g⋅cm-3 = kg⋅dm-3):
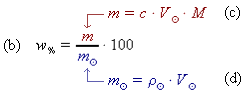

w% = 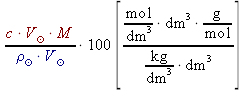 =
= = 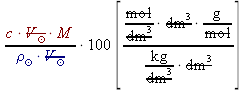 =
= = 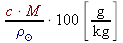 =
= 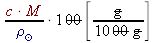 =
= 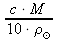
z odvozeného vztahu z e. vyjádříme molární koncentraci c:
w% = 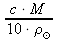
∕ ⋅ 10 ⋅ 
10 ⋅  ⋅ w% =
⋅ w% = c ⋅ M ∕ : M 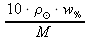 =
= c c =
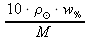 ,
,kde c ..... molární koncentrace [mol⋅dm-3] 
..... hustota roztoku v [g⋅cm-3] w% ..... procentová koncentrace roztoku (hmotnostní procento).[%] M ..... molární hmotnost [g⋅mol-1] do odvozeného vztahu z f. dosadíme zadané hodnoty
 = 1,1493 g⋅cm-3 a w%(HCl) = 30 % a z tabulek M(HCl) ≐ 36,46 g⋅mol-1:
= 1,1493 g⋅cm-3 a w%(HCl) = 30 % a z tabulek M(HCl) ≐ 36,46 g⋅mol-1:c(HCl) =
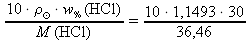 ≐ 9,46 mol⋅dm-3
≐ 9,46 mol⋅dm-3
Odpověď: Molární koncentrace 30% kyseliny chlorovodíkové je 9,46 mol⋅dm-3.
Servisního střediska pro e-learning na MU.
Technicky realizovala a odpovědnost za funkčnost nese
Veronika Švandová (2008).