Hustota látky vyjadřuje jaká je hmotnost jednoho m3 látky v kg.
Hustota látky X ρ(X) je definována jako podíl hmotnosti m(X) a objemu V(X) každého tělesa tvořeného čistou látkou X:
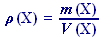 (45)
(45) | . |
Někdy se ve vzorci nezdůrazňuje, o kterou látku se konkrétně jedná a vzorec se píše pouze ve tvaru:  (46). Jindy je však pro správný výpočet nutné konkrétní látku specifikovat a zapsat ji do závorky.
(46). Jindy je však pro správný výpočet nutné konkrétní látku specifikovat a zapsat ji do závorky.
Definiční vztah (45) resp. (46) hustoty ρ(X) látky X se zavádí pro homogenní látky – tj. látky, které mají ve všech částech stejné složení. Pro nehomogenní látky se zavádí tzv. střední hustota.
Základní jednotkou hustoty je kilogram na metr krychlový kg⋅m-3. Nejužívanějšími jednotkami jsou g⋅cm-3 = g⋅ml-1 = kg⋅dm-3 = kg⋅l-1 = 103 kg⋅m-3 = 103 g⋅dm-3.
Odvozené vztahy ze vztahu (45) resp. (46) jsou:
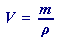 (47)
(47) | , |
 (48)
(48) | , |
| kde | V | ..... | objem látky X [cm3] |
| m | ..... | hmotnost látky X [g] | |
| ρ | ..... | hustota látky X [g⋅cm-3]. |
Pro hustotu také platí:
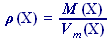 (49)
(49) | resp. | 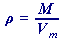 (50)
(50) | , |
| kde | ρ(X) resp. ρ | ..... | hustota látky X [g⋅dm-3] |
| M(X) resp. M | ..... | molární hmotnost látky X [g⋅mol-1] | |
| Vm(X) resp. Vm | ..... | molární objem látky X [dm3⋅mol-1]. |
Odvozené vztahy ze vztahu (49) resp. (50) jsou:
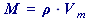 (51)
(51) | , |
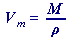 (52)
(52) | , |
| kde | M | ..... | molární hmotnost látky X [g⋅mol-1] |
| ρ | ..... | hustota látky X [g⋅dm-3] | |
| Vm | ..... | molární objem látky X [dm3⋅mol-1]. |
Hustota roztoku závisí na jeho složení a hustota směsí i čistých látek (stejně jako jejich objem) závisí na teplotě a tlaku. Tato závislost je výrazná především u plynů.
Standardní hustota látky X ρ0(X) je je hustota dané látky za standardních podmínek.
V příkladech je často využívána hustota vody: 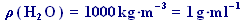 (53) (tato hodnota je za standardních podmínek i např. při 20 °C přibližně stejná). Pro objem vody podle (47) platí
(53) (tato hodnota je za standardních podmínek i např. při 20 °C přibližně stejná). Pro objem vody podle (47) platí  (54). Přibližně tedy platí, že:
(54). Přibližně tedy platí, že:
Hmotnost vody vyjádřená v gramech je číselně rovna objemu vody vyjádřenému v ml resp. cm3:
| m(H2O) g ~ V(H2O) ml | . |
Servisního střediska pro e-learning na MU.
Technicky realizovala a odpovědnost za funkčnost nese
Veronika Švandová (2008).