2.8 Výpočet molárních zlomků složek roztoku z jejich zadaných hmotností
Vypočtěte molární zlomky jednotlivých složek roztoku, který vznikl rozpouštěním 20 g NaCl v 80 g vody.
Řešení:
m(NaCl) = 20 g
m(H2O) = 80 g
x(NaCl) = ?
x(H2O) = ?
vyjdeme z definičních vztahu molárního zlomku látky X v roztoku
 (87) – potřebujeme tedy zjistit látkové množství jednotlivých složek roztoku a celkové látkové množství jednotlivých složek v roztoku
(87) – potřebujeme tedy zjistit látkové množství jednotlivých složek roztoku a celkové látkové množství jednotlivých složek v roztokunejdříve určíme látkové množství NaCl a vody
z tabulek určíme molární hmotnosti chloridu sodného a vody:
M(NaCl) ≐ 58,44 g⋅mol-1
M(H2O) ≐ 18,02 g⋅mol-1
využijeme odvozený vztah (28) pro látkové množství:

do vztahu z B. dosadíme zadané hodnoty m(NaCl) = 20 g a m(H2O) = 80 g a M(NaCl) ≐ 58,44 g⋅mol-1 a M(H2O) ≐ 18,02 g⋅mol-1 z a.:
n(NaCl) =
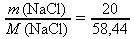 ≐ 0,34 mol
≐ 0,34 moln(H2O) =
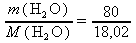 ≐ 4,44 mol
≐ 4,44 mol
nyní zjistíme celkové látkové množství jednotlivých složek v roztoku

podle (88) platí, že
 je rovno součtu látkových množství všech látek Xi obsažených v soustavě, tj.
je rovno součtu látkových množství všech látek Xi obsažených v soustavě, tj. 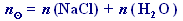
do vztahu z B. dosadíme zadané hodnoty n(NaCl) = 0,34 mol a n(H2O) = 4,44 mol:
 = n(NaCl) + n(H2O) = 0,34 + 4,44 = 4,78 mol
= n(NaCl) + n(H2O) = 0,34 + 4,44 = 4,78 mol
vypočteme molární zlomky jednotlivých složek roztoku
molární zlomky složek roztoku získáme dosazením n(NaCl) = 0,34 mol a n(H2O) = 4,44 mol z b. a
 = 4,78 mol z c.do definičního vztahu z a.
= 4,78 mol z c.do definičního vztahu z a.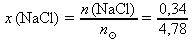 = 0,07
= 0,07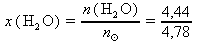 = 0,93
= 0,93kontrola : 0,07 + 0,93 = 1
Odpověď: Molární zlomek NaCl v roztoku je 0,07 a molární zlomek vody v roztoku je 0,93.
Servisního střediska pro e-learning na MU.
Technicky realizovala a odpovědnost za funkčnost nese
Veronika Švandová (2008).