1.10 Výpočet hmotnosti 1 molu daných atomů
Jaká je hmotnost 1 molu atomů vodíku?
Řešení:
n(H) = 1 mol
m(H) = ?
hmotnost 1 molu libovolných elementárních částic, tedy i hmotnost 1 molu atomů vodíku udává jeho molární hmotnost M(H)
molární hmotnost M(X) atomu X vyjádřená v g⋅mol-1 je číselně rovna relativní atomové hmotnosti Ar(X), jejíž hodnoty jsou uvedeny periodické soustavě prvků
z tabulek určíme: Ar(H) = 1,0079
 M(H) = Ar(H) = 1,0079 g⋅mol-1
M(H) = Ar(H) = 1,0079 g⋅mol-1z a. a c. pro hmotnost m(H) 1 molu atomů vodíku plyne: m(H) = 1,0079 ≐ 1,01 g
Odpověď: 1 mol atomů vodíku má hmotnost 1,01 g.
1.11 Výpočet hmotnosti 1 molu daných molekul
Jaká je hmotnost 1 molu molekul vodíku?
Řešení:
n(H2) = 1 mol
m(H2) = ?
hmotnost 1 molu libovolných elementárních částic, tedy i hmotnost 1 molekul vodíku udává jejich molární hmotnost M(H2)
molární hmotnost M(Y) molekuly Y vyjádřená v g⋅mol-1 je číselně rovna relativní molekulové hmotnosti Mr(Y), kterou lze podle (20) vypočítat jako součet relativních atomových hmotností všech atomů tvořících molekulu Y
z tabulek určíme: Ar(H) = 1,0079
z b. plyne:
Mr(H2) = 2 ⋅ Ar(H) = 2 ⋅ 1,0079 = 2,0158 ≐ 2,02 M(H2) = 2,02 g⋅mol-1 z a. a d. plyne: hmotnost m(H2) 1 molu molekul vodíku je m(H2) = 2,02 g
Odpověď: 1 mol molekul vodíku má hmotnost 2,02 g.
1.12 Výpočet hmotnosti 1 molu dané chemické sloučeniny
Jaká je hmotnost 1 molu amoniaku?
Řešení:
n(NH3) = 1 mol
m(NH3) = ?
hmotnost 1 molu libovolné sloučeniny, tedy i hmotnost 1 molu amoniaku udává jeho molární hmotnost M(NH3)
molární hmotnost M(Y) molekuly Y vyjádřená v g⋅mol-1 je číselně rovna relativní molekulové hmotnosti Mr(Y), kterou lze podle (20) vypočítat jako součet relativních atomových hmotností všech atomů tvořících molekulu Y
z b. plyne:
Mr(NH3) = Ar(N) + 3 ⋅ Ar(H) = 14,0067 + 3 ⋅ 1,0079 ≐ 17,03 M(NH3) = 17,03 g⋅mol-1 z a. a c. plyne: hmotnost m(NH3) 1 molu amoniaku je m(NH3) = 17,03 g
Odpověď: 1 mol amoniaku má hmotnost 17,03 g.
1.13 Výpočet látkového množství daných atomů ze zadané hmotnosti
Kolik molů je 50,00 g atomů vodíku?
Řešení:
m(H) = 50,00 g
n(H) = ?
1. postup – úvahou s využitím přímé úměrnosti
víme, že hmotnost 1 molu atomů vodíku udává jejich molární hmotnost
z tabulek určíme, že M(H) ≐ 1,0079 g⋅mol-1, hmotnost 1 molu atomů H je tedy 1,0079 g
hledané látkové množství 50,00 g atomů vodíku proto můžeme vypočítat užitím přímé úměrnosti:

1 mol atomů H .................. 1,0079 g 
x mol atomů H .................. 50,00 g x : 1 = 50,00 : 1,0079 x = 
x ≐ 49,61 mol atomů H ~ n(H)
2. postup – dosazením do odvozeného vztahu
využijeme odvozený vztah (28) pro látkové množství:

do vztahu z a. dosadíme zadanou hodnotu m(H) = 50,00 g a M(H) ≐ 1,0079 g⋅mol-1 z tabulek:
n(H) =
 =
=  ≐ 49,61 mol
≐ 49,61 mol
Odpověď: 50,00 gramů atomů vodíku je 49,61 molů těchto atomů.
1.14 Výpočet látkového množství daného prvku ze zadané hmotnosti
Kolik molů je 50,00 g vápníku?
Řešení:
m(Ca) = 50,00 g
n(Ca) = ?
1. postup – úvahou s využitím přímé úměrnosti
víme, že hmotnost 1 molu vápníku udává jeho molární hmotnost
z tabulek určíme, že M(Ca) ≐ 40,08 g⋅mol-1, hmotnost 1 molu Ca je tedy 40,08 g
hledané látkové množství 50,00 g vápníku proto můžeme vypočítat užitím přímé úměrnosti:

1 mol Ca .................. 40,08 g 
x mol Ca .................. 50,00 g x : 1 = 50,00 : 40,08 x = 
x ≐ 1,25 mol Ca ~ n(Ca)
2. postup – dosazením do odvozeného vztahu
využijeme odvozený vztah (28) pro látkové množství:

do vztahu z a. dosadíme zadanou hodnotu m(Ca) = 50,00 g a M(Ca) ≐ 40,08 g⋅mol-1 z tabulek:
n(Ca) =
 =
=  ≐ 1,25 mol
≐ 1,25 mol
Odpověď: 50,00 gramů vápníku je 1,25 molů tohoto prvku.
1.15 Výpočet látkového množství dané sloučeniny ze zadané hmotnosti
Kolik molů je 50,00 g amoniaku?
Řešení:
m(NH3) = 50,00 g
n(NH3) = ?
1. postup – úvahou s využitím přímé úměrnosti
víme, že hmotnost 1 molu amoniaku udává jeho molární hmotnost
z tabulek určíme, že M(NH3) ≐ 17,03 g⋅mol-1, hmotnost 1 molu NH3 je tedy 17,03 g
hledané látkové množství 50,00 g amoniaku proto můžeme vypočítat užitím přímé úměrnosti:

1 mol NH3 .................. 17,03 g 
x mol NH3 .................. 50,00 g x : 1 = 50,00 : 17,03 x = 
x ≐ 2,94 mol NH3 ~ n(NH3)
2. postup – dosazením do odvozeného vztahu
využijeme odvozený vztah (28) pro látkové množství:

do vztahu z a. dosadíme zadanou hodnotu m(NH3) = 50,00 g a M(NH3) ≐ 17,03 g⋅mol-1 z tabulek:
n(NH3) =
 =
=  ≐ 2,94 mol
≐ 2,94 mol
Odpověď: 50,00 gramů amoniaku je 2,94 molů této sloučeniny.
1.16 Výpočet molární hmotnosti dané chemické sloučeniny ze zadané hmotnosti a látkového množství
Bez použití tabulek vypočtěte molární hmotnost uhličitanu vápenatého, víte-li že 5 molů CaCO3 má hmotnost 500,45 g?
Řešení:
n(CaCO3) = 5 mol
m(CaCO3) = 500,45 g
M(CaCO3) = ?
1. postup – úvahou s využitím přímé úměrnosti
víme, že molární hmotnost CaCO3 udává hmotnost 1 molu této látky
molární hmotnost 5 mol CaCO3 proto můžeme vypočítat užitím přímé úměrnosti:

500,45 g .................. 5 mol CaCO3 
x g .................. 1 mol CaCO3 x : 500,45 = 1 : 5 x = 
x = 100,09 g CaCO3  M(CaCO3) = 100,09 g⋅mol-1
M(CaCO3) = 100,09 g⋅mol-1
2. postup – dosazením do definičního vztahu
k výpočtu využijeme definiční vztah molární hmotnosti
 (25)
(25)do vztahu z a. můžeme dosadit známé hodnoty pro CaCO3 m(CaCO3) = 500,45 g a n(CaCO3) = 5 mol:
M(CaCO3) =
 =
=  ≐ 100,09 g⋅mol-1
≐ 100,09 g⋅mol-1
Odpověď: Molární hmotnost uhličitanu vápenatého je 100,09 g⋅mol-1.
1.17 Výpočet hmotnosti dané chemické sloučeniny ze zadaného látkového množství
Vypočtěte hmotnost 5 molů hydroxidu draselného.
Řešení:
n(KOH) = 5 mol
m(KOH) = ?
1. postup – úvahou s využitím přímé úměrnosti
hmotnost 1 molu KOH udává jeho molární hmotnost M(KOH) ≐ 56,11 g⋅mol-1
podle a. je tedy hmotnost 1 molu KOH 56,11 g, a proto hledanou hmotnost 5 molů KOH můžeme vypočítat užitím přímé úměrnosti:

56,11 g .................. 1 mol KOH 
x g .................. 5 mol KOH x : 56,11 = 5 : 1 x =  = 5 ⋅ 56,11
= 5 ⋅ 56,11x = 280,55 g KOH ~ m(KOH)
2. postup – dosazením do odvozeného vztahu
využijeme odvozený vztah (27) pro hmotnost:

do vztahu z a. dosadíme zadanou hodnotu n(KOH) = 5 mol a M(KOH) ≐ 56,11 g⋅mol-1 z tabulek:
m(KOH) = n (KOH) ⋅ M(KOH) = 5 ⋅ 56,11 = 280,55 g
Odpověď: 5 molů hydroxidu draselného má hmotnost 280,55 g.
1.18 Výpočet hmotnosti atomů z jejich zadaného počtu
Určete hmotnost 1⋅1023 atomů zlata. Relativní atomová hmotnost zlata je Ar(Au) = 196,97.
Řešení:
Ar(Au) = 196,97
N(Au) = 1⋅1023
m(Au) = ?
1. postup – úvahou s využitím přímé úměrnosti
nejdříve vypočteme látkové množství Au
víme, že počet částic v jednom molu jakékoliv látky udává Avogadrova konstanta NA ≐ 6,022⋅1023 (21)
podle A. 1 mol zlata obsahuje 6,022⋅1023 atomů zlata, a proto hledané látkové množství 1⋅1023 atomů zlata můžeme vypočítat užitím přímé úměrnosti:

1 mol Au .................. 6,022⋅1023 atomů Au 
x mol Au .................. 1⋅1023 atomů Au x : 1 = 1⋅1023 : 6,022⋅1023 x =  ~ n(Au)
~ n(Au)
pomocí látkového množství z a. vypočteme hmotnost Au
víme, že hmotnost 1 molu Au udává jeho molární hmotnost M(Au), která vyjádřená v g⋅mol-1 je číselně rovna relativní atomové hmotnosti Ar(Au) = 196,97
podle A. hmotnost 1 molu Au je 196,97 g a hledanou hmotnost 0,166 molů Au můžeme vypočítat užitím přímé úměrnosti:

196,97 g .................. 1 mol Au 
y g Au .................. 0,166 mol Au y : 196,97 = 0,166 : 1 y =  = 0,166 ⋅ 196,97 ≐ 32,70 g ~ m(Au)
= 0,166 ⋅ 196,97 ≐ 32,70 g ~ m(Au)
2. postup – úvahou s využitím kombinace přímých úměr
víme, že počet částic v jednom molu jakékoliv látky udává Avogadrova konstanta NA ≐ 6,022⋅1023 (21)
1 mol zlata tedy obsahuje 6,022⋅1023 atomů zlata
dále víme, že hmotnost 1 molu Au udává jeho molární hmotnost M(Au), která vyjádřená v g⋅mol-1 je číselně rovna relativní atomové hmotnosti Ar(Au) = 196,97
hmotnost 1 molu Au je tedy 196,97 g
hledanou hmotnost 1⋅1023 atomů Au můžeme vypočítat užitím kombinace přímých úměr, které sestavíme pomocí údajů z aB. a bB. a ze zadání (N(Au) = 1⋅1023):

1 mol Au .................. 6,022⋅1023 atomů Au .................. 196,97 g Au 
x mol Au .................. 1⋅1023 atomů Au .................. y g Au Veličinu x počítat nemusíme, neboť nás zajímá pouze hledaná veličina y (hmotnost): y : 196,97 = 1⋅1023 : 6,022⋅1023
y =  ≐ 32,71 g ~ m(Au)
≐ 32,71 g ~ m(Au)
3. postup – postupným dosazováním do jednoduchých vztahů
nejdříve vypočteme látkové množství Au
využijeme odvozený vztah (24) pro látkové množství:

do vztahu z A. můžeme dosadit známou hodnotu N(Au) = 1⋅1023 i Avogadrovu konstantu NA ≐ 6,022⋅1023 mol-1:
n(Au) =
 =
= 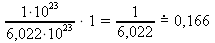 mol
mol
pomocí látkového množství z a. vypočteme hmotnost Au
využijeme odvozený vztah (27) pro hmotnost:

do vztahu z A. dosadíme známou hodnotu M(Au) = 196,97 g⋅mol-1
(
 Ar(Au) = 196,97) a n(Au) = 0,166 mol z části a.:
Ar(Au) = 196,97) a n(Au) = 0,166 mol z části a.:m(Au) = n (Au) ⋅ M(Au) = 0,166 ⋅ 196,97 ≐ 32,70 g
4. postup – postupným dosazováním do jednoduchých vztahů
využijeme odvozený vztah (24) pro látkové množství:

dále využijeme odvozený vztah (27) pro hmotnost:

vztah a. dosadíme do vztahu b., čímž dostaneme vztah:

do vztahu c. můžeme dosadit známé hodnoty: M(Au) = 196,97 g⋅mol-1
(
 Ar(Au) = 196,97), N(Au) = 1⋅1023 a NA ≐ 6,022⋅1023 mol-1:
Ar(Au) = 196,97), N(Au) = 1⋅1023 a NA ≐ 6,022⋅1023 mol-1:m(Au) =
 =
=  ≐ 32,71 g
≐ 32,71 g
Odpověď: Hmotnost 1⋅1023 atomů zlata je 32,70 g (resp. 32,71 g).
1.19 Výpočet hmotnosti molekul z jejich zadaného počtu
Určete hmotnost 6,022⋅1021 molekul oxidu siřičitého. Relativní molekulová hmotnost oxidu siřičitého je Mr(SO2) = 64,06.
Řešení:
Mr(SO2) = 64,06
N(SO2) = 6,022⋅1021
m(SO2) = ?
1. postup – úvahou s využitím přímé úměrnosti
nejdříve vypočteme látkové množství SO2
víme, že počet částic v jednom molu jakékoliv látky udává Avogadrova konstanta NA ≐ 6,022⋅1023 (21)
podle A. 1 mol oxidu siřičitého obsahuje 6,022⋅1023 molekul oxidu siřičitého, a proto hledané látkové množství 6,022⋅1021 molekul oxidu siřičitého můžeme vypočítat užitím přímé úměrnosti:

1 mol SO2 .................. 6,022⋅1023 molekul SO2 
x mol SO2 .................. 6,022⋅1021 molekul SO2 x : 1 = 6,022⋅1021 : 6,022⋅1023 x =  = 0,01 mol SO2 ~ n(SO2)
= 0,01 mol SO2 ~ n(SO2)
pomocí látkového množství z a. vypočteme hmotnost SO2
víme, že hmotnost 1 molu SO2 udává jeho molární hmotnost M(SO2), která vyjádřená v g⋅mol-1 je číselně rovna relativní atomové hmotnosti Mr(SO2) = 64,06
podle A. hmotnost 1 molu SO2 je 64,06 g a hledanou hmotnost 0,01 molů SO2 můžeme vypočítat užitím přímé úměrnosti:

64,06 g SO2 .................. 1 mol SO2 
y g SO2 .................. 0,01 mol SO2 y : 64,06 = 0,01 : 1 y =  = 0,01 ⋅ 64,06 ≐ 0,64 g ~ m(SO2)
= 0,01 ⋅ 64,06 ≐ 0,64 g ~ m(SO2)x = 0,17 mol Ag ~ n(Ag)
2. postup – úvahou s využitím kombinace přímých úměr
víme, že počet částic v jednom molu jakékoliv látky udává Avogadrova konstanta NA ≐ 6,022⋅1023 (21)
1 mol oxidu siřičitého tedy obsahuje 6,022⋅1023 molekul oxidu siřičitého
dále víme, že hmotnost 1 molu SO2 udává jeho molární hmotnost M(SO2), která vyjádřená v g⋅mol-1 je číselně rovna relativní molekulové hmotnosti Mr(SO2) = 64,06
hmotnost 1 molu SO2 je tedy 64,06 g
hledanou hmotnost 6,022⋅1021 molekul SO2 můžeme vypočítat užitím kombinace přímých úměr, které sestavíme pomocí údajů z aB. a bB. a ze zadání (N(SO2) = 6,022⋅1021):

1 mol SO2 .................. 6,022⋅1023 molekul SO2 .................. 64,06 g SO2 
x mol SO2 .................. 6,022 ⋅ 1021 molekul SO2 .................. y g SO2 Veličinu x počítat nemusíme, neboť nás zajímá pouze hledaná veličina y (hmotnost): y : 64,06 = 6,022 ⋅ 1021 : 6,022⋅1023
y =  ≐0,64 g ~ m(SO2)
≐0,64 g ~ m(SO2)
3. postup – postupným dosazováním do jednoduchých vztahů
nejdříve vypočteme látkové množství SO2
využijeme odvozený vztah (24) pro látkové množství:

do vztahu z A. můžeme dosadit známou hodnotu N(SO2) = 6,022⋅1021 i Avogadrovu konstantu NA ≐ 6,022⋅1023 mol-1:
n(SO2) =
 =
=  ≐ 0,01 mol
≐ 0,01 mol
pomocí látkového množství z a. vypočteme hmotnost SO2
využijeme odvozený vztah (27) pro hmotnost:

do vztahu z A. dosadíme známou hodnotu M(SO2) = 64,06 g⋅mol-1
(
 Mr(SO2) = 64,06) a n (SO2) = 0,01 mol z části a.:
Mr(SO2) = 64,06) a n (SO2) = 0,01 mol z části a.:m(SO2) = n (SO2) ⋅ M(SO2) = 0,01 ⋅ 64,06 ≐ 0,64 g
4. postup – dosazením do odvozeného vztahu
využijeme odvozený vztah (24) pro látkové množství:

dále využijeme odvozený vztah (27) pro hmotnost:

vztah a. dosadíme do vztahu b., čímž dostaneme vztah:

do vztahu c. můžeme dosadit známé hodnoty: M(SO2) = 64,06 g⋅mol-1
(
 Mr(SO2) = 64,06), N(SO2) = 6,022⋅1021 a NA ≐ 6,022⋅1023 mol-1:
Mr(SO2) = 64,06), N(SO2) = 6,022⋅1021 a NA ≐ 6,022⋅1023 mol-1:m(SO2) =
 =
=  ≐ 0,64 g
≐ 0,64 g
Odpověď: Hmotnost 6,022⋅1021 molekul oxidu siřičitého je 0,64 g.
1.20 Výpočet počtu atomů z jejich zadané hmotnosti
Kolik atomů mědi je obsaženo ve 127 g mědi? Relativní atomová hmotnost mědi je Ar(Cu) = 63,546.
Řešení:
Ar(Cu) = 63,546
m(Cu) = 127 g
N(Cu) = ?
1. postup – úvahou s využitím přímé úměrnosti
nejdříve vypočteme látkové množství Cu
víme, že hmotnost 1 molu Cu udává jeho molární hmotnost M(Cu), která vyjádřená v g⋅mol-1 je číselně rovna relativní atomové hmotnosti Ar(Cu) = 63,546
podle A. hmotnost 1 molu Cu je 63,546 g, a proto hledané látkové množství 127 g měďi můžeme vypočítat užitím přímé úměrnosti:

1 mol Cu .................. 63,546 g Cu 
x mol Cu .................. 127 g Cu x : 1 = 127 : 63,546 x =  ≐ 1,999 mol ~ n(Cu)
≐ 1,999 mol ~ n(Cu)
pomocí látkového množství z a. vypočteme počet atomů Cu
víme, že počet částic v jednom molu jakékoliv látky udává Avogadrova konstanta NA ≐ 6,022⋅1023 (21)
podle A. 1 mol mědi obsahuje 6,022⋅1023 molekul mědi, a proto hledaný počet atomů v 1,999 molech Cu můžeme vypočítat užitím přímé úměrnosti:

6,022⋅1023 atomů Cu .................. 1 mol Cu 
y atomů Cu .................. 1,999 mol Cu y : 6,022⋅1023 = 1,999 : 1 y =  = 1,999 ⋅ 6,022⋅1023
= 1,999 ⋅ 6,022⋅1023y ≐ 1,20⋅1024 atomů Cu ~ N(Cu)
2. postup – úvahou s využitím kombinace přímých úměr
víme, že hmotnost 1 molu Cu udává jeho molární hmotnost M(Cu), která vyjádřená v g⋅mol-1 je číselně rovna relativní atomové hmotnosti Ar(Cu) = 63,546
hmotnost 1 molu Cu je tedy 63,546 g
dále víme, že počet částic v jednom molu jakékoliv látky udává Avogadrova konstanta NA ≐ 6,022⋅1023 (21)
1 mol měďi tedy obsahuje 6,022⋅1023 atomů měďi
hledanou hmotnost 127 g Cu můžeme vypočítat užitím kombinace přímých úměr, které sestavíme pomocí údajů z aB. a bB. a ze zadání (m(Cu) = 127 g):

1 mol Cu .................. 63,546 g Cu .................. 6,022⋅1023 atomů Cu 
x mol Cu .................. 127 g Cu .................. y atomů Cu Veličinu x počítat nemusíme, neboť nás zajímá pouze hledaná veličina y (počet atomů): y : 6,022⋅1023 = 127 : 63,546
y =  ≐ 1,20⋅1024 atomů Cu ~ N(Cu)
≐ 1,20⋅1024 atomů Cu ~ N(Cu)
3. postup – postupným dosazováním do jednoduchých vztahů
nejdříve vypočteme látkové množství Cu
využijeme odvozený vztah (28) pro látkové množství:

do vztahu z A. dosadíme známé hodnoty m(Cu) = 127 g a M(Cu) = 63,546 g⋅mol-1 (
 Ar(Cu) = 63,546):
Ar(Cu) = 63,546):n(Cu) =
 =
=  ≐ 1,999 mol
≐ 1,999 mol
pomocí látkového množství z a. vypočteme počet atomů Cu
využijeme odvozený vztah (23) pro počet částic: N = n ⋅ NA
do vztahu z A. můžeme dosadit známou hodnotu n(Cu) = 1,999 mol z části a. i Avogadrovu konstantu NA ≐ 6,022⋅1023 mol-1:
N(Cu) = n(Cu) ⋅ NA = 1,999 ⋅ 6,022⋅1023 ≐ 1,20⋅1024 atomů
4. postup – dosazením do odvozeného vztahu
využijeme odvozený vztah (28) pro látkové množství:

využijeme odvozený vztah (23) pro počet částic: N = n ⋅ NA
vztah a. dosadíme do vztahu b., čímž dostaneme vztah:

do vztahu c. můžeme dosadit známé hodnoty: m(Cu) = 127 g, M(Cu) = 63,546 g⋅mol-1 (
 Ar(Cu) = 63,546) a NA ≐ 6,022⋅1023 mol-1:
Ar(Cu) = 63,546) a NA ≐ 6,022⋅1023 mol-1:N(Cu) =
 ≐ 1,20⋅1024 atomů
≐ 1,20⋅1024 atomů
Odpověď: Ve 127 g mědi je obsaženo 1,20⋅1024 atomů Cu.
1.21 Výpočet počtu molekul z jejich zadané hmotnosti
Kolik molekul oxidu uhličitého je obsaženo ve 22 g oxidu uhličitého? Relativní molekulová hmotnost oxidu uhličitého je Mr(CO2) = 44,01.
Řešení:
Mr(CO2) = 44,01
m(CO2) = 22 g
N(CO2) = ?
1. postup – úvahou s využitím přímé úměrnosti
nejdříve vypočteme látkové množství CO2
víme, že hmotnost 1 molu CO2 udává jeho molární hmotnost M(CO2), která vyjádřená v g⋅mol-1 je číselně rovna relativní atomové hmotnosti Mr(CO2) = 44,01
podle A. hmotnost 1 molu CO2 je 44,01 g, a proto hledané látkové množství 22 g CO2 můžeme vypočítat užitím přímé úměrnosti:

1 mol CO2 .................. 44,01 g CO2 
x mol CO2 .................. 22 g CO2 x : 1 = 22 : 44,01 x = 
x ≐ 0,50 mol ~ n(CO2)
pomocí látkového množství z a. vypočteme počet molekul CO2
víme, že počet částic v jednom molu jakékoliv látky udává Avogadrova konstanta NA ≐ 6,022⋅1023 (21)
podle A. 1 mol CO2 obsahuje 6,022⋅1023 molekul CO2, a proto hledaný počet molekul v 0,50 molech CO2 můžeme vypočítat užitím přímé úměrnosti:

6,022⋅1023 molekul CO2 .................. 1 mol CO2 
y molekul CO2 .................. 0,50 mol CO2 y : 6,022⋅1023 = 0,50 : 1 y =  = 0,50 ⋅ 6,022⋅1023
= 0,50 ⋅ 6,022⋅1023y ≐ 3,01⋅1023 molekul CO2 ~ N(CO2)
2. postup – úvahou s využitím kombinace přímých úměr
víme, že hmotnost 1 molu CO2 udává jeho molární hmotnost M(CO2), která vyjádřená v g⋅mol-1 je číselně rovna relativní molekulové hmotnosti Mr(CO2) = 44,01
hmotnost 1 molu CO2 je tedy 44,01 g
dále víme, že počet částic v jednom molu jakékoliv látky udává Avogadrova konstanta NA ≐ 6,022⋅1023 (21)
1 mol oxidu uhličitého tedy obsahuje 6,022⋅1023 molekul oxidu uhličitého
hledanou hmotnost 22 g CO2 můžeme vypočítat užitím kombinace přímých úměr, které sestavíme pomocí údajů z aB. a bB. a ze zadání (m(CO2) = 22 g):

1 mol CO2 .................. 44,01 g CO2 .................. 6,022⋅1023 molekul CO2 
x mol CO2 .................. 22 g CO2 .................. y molekul CO2 Veličinu x počítat nemusíme, neboť nás zajímá pouze hledaná veličina y (počet molekul): y : 6,022⋅1023 = 22 : 44,01
y =  ≐ 3,01⋅1023 molekul CO2 ~ N(CO2)
≐ 3,01⋅1023 molekul CO2 ~ N(CO2)
3. postup – postupným dosazováním do jednoduchých vztahů
nejdříve vypočteme látkové množství CO2
využijeme odvozený vztah (28) pro látkové množství:

do vztahu z A. dosadíme známé hodnoty m(CO2) = 22 g a M(CO2) = 44,01 g⋅mol-1 (
 Mr(CO2) = 44,01):
Mr(CO2) = 44,01):n(CO2) =
 =
= 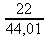 ≐ 0,50 mol
≐ 0,50 mol
pomocí látkového množství z a. vypočteme počet molekul CO2
využijeme odvozený vztah (23) pro počet částic: N = n ⋅ NA
do vztahu z A. můžeme dosadit známou hodnotu n(CO2) = 0,50 mol z části a. i Avogadrovu konstantu NA ≐ 6,022⋅1023 mol-1:
N(CO2) = n(CO2) ⋅ NA = 0,50 ⋅ 6,022⋅1023 ≐ 3,01⋅1023 molekul
4. postup – dosazením do odvozeného vztahu
využijeme odvozený vztah (28) pro látkové množství:

dále využijeme odvozený vztah (23) pro počet částic: N = n ⋅ NA
vztah (28) z a. dosadíme do vztahu (23) z b., čímž dostaneme vztah:

do vztahu c. můžeme dosadit známé hodnoty: m(CO2) = 22 g, M(CO2) = 44,01 g⋅mol-1 (
 Mr(CO2) = 44,01) a NA ≐ 6,022⋅1023 mol-1:
Mr(CO2) = 44,01) a NA ≐ 6,022⋅1023 mol-1:N(CO2) =
 ≐ 3,01⋅1023 molekul
≐ 3,01⋅1023 molekul
Odpověď: Ve 22 g oxidu uhličitého je obsaženo 3,01⋅1023 molekul CO2.
Servisního střediska pro e-learning na MU.
Technicky realizovala a odpovědnost za funkčnost nese
Veronika Švandová (2008).